エントロピー(熱力学第二法則)【熱力学 2】
さて、熱力学第一法則により、密閉容器に閉じ込めた気体の内部エネルギー は、気体に加える熱
と、外力が気体にする仕事
の分だけ増加するということでした。式で書くと
でした。
しかし、熱とか仕事というのは全微分で表せない(=始点から終点までの積分経路によって値が異なる=始点の状態と終点の状態だけからは値が定まらない)ので ではなく
で表記しました。
という話をしたのが前回↓
limnanthaceae.hatenablog.com
熱力学第一法則では、 であったので、残りの
をどうにかする。
カルノーの定理
温度 の高温熱源から
の熱を受け取り、温度
の低温熱源に
の熱を流す熱機関を考えます。
不可逆機関の効率は可逆機関の効率より小さく、最大効率は作業物質によらず2つの温度のみで決定されます。
可逆機関の効率は
であり、不可逆機関の効率はこれより小さくなります。
エントロピー
カルノーの定理を変形すると
が成り立ちます。
Qの符号について、吸熱を正、放熱を負と再定義すると、
準静的=可逆過程だと(不可逆とは?)多数のカルノーサイクルに分割できるので
つまり、極限的には周回積分
が成り立ちます。
ということは、
という積分は、どのような経路で積分しても成り立つということです。
例えば、状態A→状態B→状態C→状態D→状態Aという順番で一周する経路を考えます。
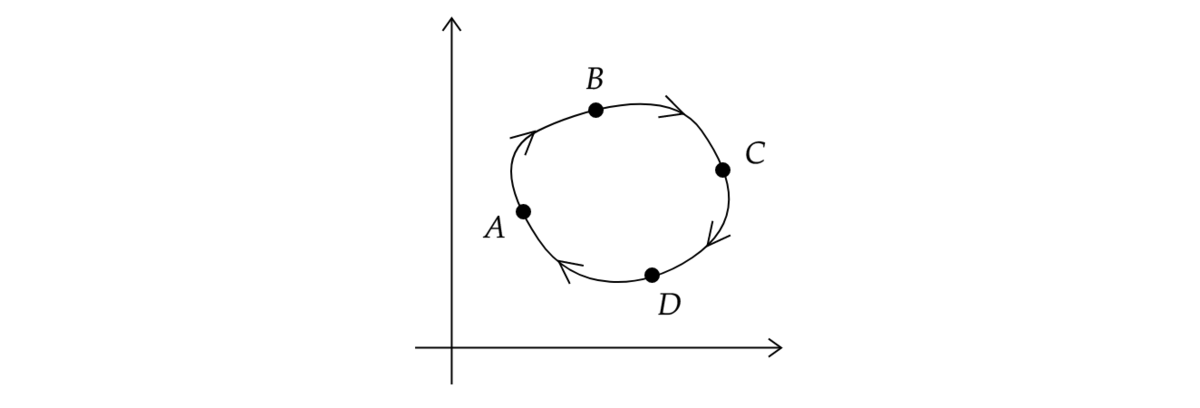
全体の周回積分が0なので、状態A→状態B→状態Cと状態C→状態D→状態Aの経路積分に分けて考えると
となり、
つまり、
なので、経路によらず状態A→状態Cの積分値は一致します。
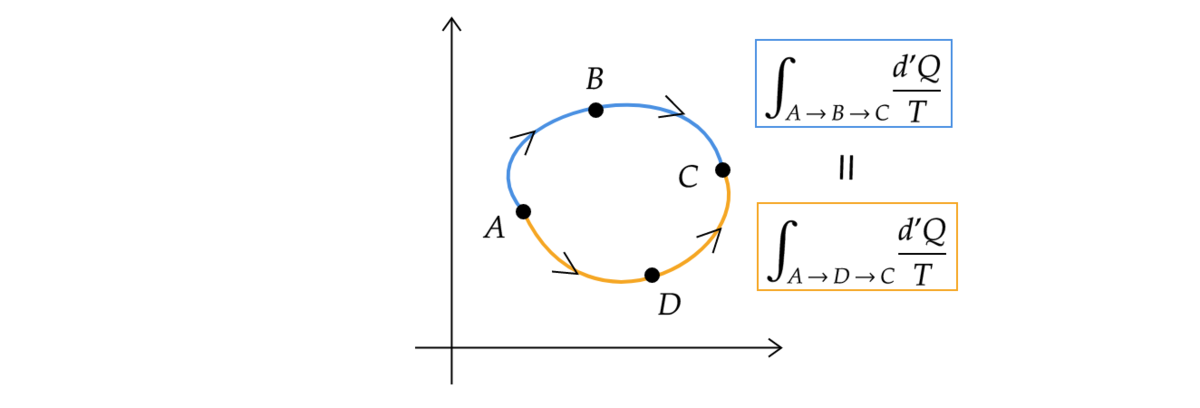
ので、エントロピー を
で定義すると、
で定義されることが多いです。