高校物理と偏微分くらいはわかっている前提
つまり、「内部エネルギーの変化量=加えた仕事+加えた熱」なんだけど、「外部から受け取る仕事と熱は変化の過程によるけど、その和は変化の過程によらず内部エネルギーの変化量に等しい」というやばい結論が得られる。
そもそも微分の定義が終点と始点の平均変化量なのでね
こいつが何から導出されたかという話。
熱力学がやりたいこと
そもそも熱力学とは、「効率のいい熱機関(蒸気機関とかガソリンエンジンとか)を作る」ため、気体のエネルギーがどう変化するかを調べる、という理解でいいんじゃないでしょうかね。雑にいうと、閉鎖空間に閉じ込めた気体になんか操作したときに気体の温度がどう変化するか。まあ熱と温度は別物なんですけども。
熱力学第一法則
まず、気体の内部エネルギーというものを考えます。内部エネルギーとは、気体を構成する全分子の運動エネルギー(と本当は位置エネルギー)の総和です。で、なんやかんややると温度が内部エネルギーに比例することがわかります(単原子分子理想気体の場合
、
:気体の物質量[mol]、
:気体定数、
:温度)。というわけでこの内部エネルギーを調べたらいろいろわかるはず。
外力が気体にした仕事をとします。例によってピストンモデルを考えます。外力が仕事した分が内部エネルギーとして気体に蓄えられるとすると、
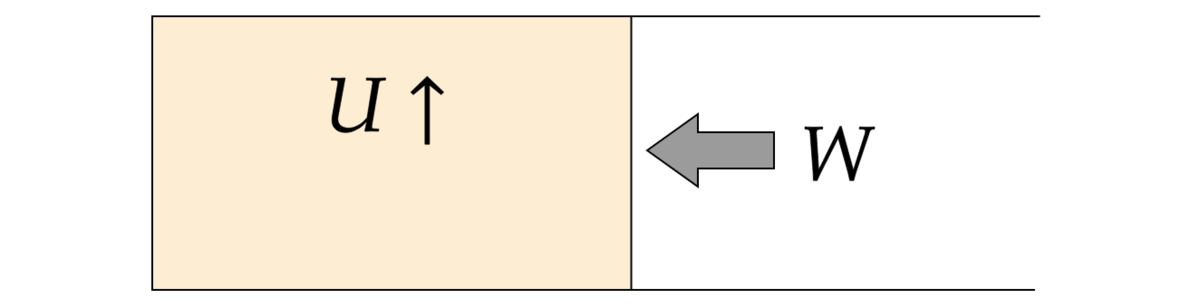
しかし、実際は仕事以外の要因で内部エネルギーが増加する場合がある。つまりこれが「熱を加えた」ときということ。
内部エネルギーの増加分から仕事した分を引いたものを熱と定義します。
式変形すると、

微小変化に対しては、次のように微分の形で書くことができます:
これが熱力学第一法則。
ここで、は状態量=全微分の形に書けますが、
は状態量ではない=全微分できないので
を使って表記しています。
全微分とは何ぞや?という数学的な話は過去記事でまとめていますので、そちらを参照してください。
limnanthaceae.hatenablog.com